Czy czas odejść od tablicy Mendelejewa?
Pośród rzucanych na poważnie i dla żartu coraz to absurdalniejszych pomysłów na wykluczanie z przestrzeni publicznej wszystkiego, co związane z Rosją, natrafiłem również na koncepcję odejścia od tzw. tablicy Mendelejewa w nauczaniu chemii. Dla przypomnienia, tablica ta to lista znanych pierwiastków, pogrupowanych w sposób mający ułatwić zapamiętanie (przewidzenie) ich właściwości. Pomysł wyrugowania tego wynalazku, zabawny na kilku poziomach, skłonił mnie jednak do podjęcia próby przeanalizowania historii i znaczenia systematyzowania pierwiastków chemicznych. I przedstawienia stosunkowo nowego, polskiego głosu w tej sprawie.
Żeby jednak przedstawić sprawę wyczerpująco, zacznę od tego, czym w ogóle jest pierwiastek. Jak wszyscy wiedzą, prawie cała otaczająca nas materia zbudowana jest z atomów. Nie jest to do końca ścisłe, ale trudno. Każdy atom składa się z małego, ciężkiego jądra o dodatnim ładunku elektrycznym i elektronów, których ładunek jest ujemny. Elektrony otaczają jądro będąc z nim mocniej bądź luźniej związane. Te najluźniej związane robią różne fiku-miku z elektronami innych atomów i to elektronowe cimcirimcim nazywamy chemią.
Żeby jednak przedstawić sprawę wyczerpująco, zacznę od tego, czym w ogóle jest pierwiastek. Jak wszyscy wiedzą, prawie cała otaczająca nas materia zbudowana jest z atomów. Nie jest to do końca ścisłe, ale trudno. Każdy atom składa się z małego, ciężkiego jądra o dodatnim ładunku elektrycznym i elektronów, których ładunek jest ujemny. Elektrony otaczają jądro będąc z nim mocniej bądź luźniej związane. Te najluźniej związane robią różne fiku-miku z elektronami innych atomów i to elektronowe cimcirimcim nazywamy chemią.
To jest model atomu. Oczywiście jądro jest o wiele mniejsze w skali całego atomu, a elektrony nie krążą po żadnych kołowych orbitach, powłoki należy traktować raczej jako poziomy energii, z którymi dopiero skorelowany jest rozkład prawdopodobieństwa położenia elektronu.
Pierwiastkiem nazywamy atom o konkretnym ładunku dodatnim jądra, zależnym od liczby wchodzących w jego skład mniejszych cząstek, protonów. Więc tlen ma 8 protonów i ładunek jądra +8 itd. O atomie mówimy wtedy, kiedy liczba elektronów jest równa liczbie protonów, więc ładunki elektryczne równoważą się. Stąd wynika nieścisłość stwierdzenia, że większość materii składa się z atomów. Bo atomy jako takie występują rzadko (chyba największymi nagromadzeniami atomów w okolicy są balony z helem, także jak ktoś mówi, że otaczają go atomy a nie związki chemiczne, to prawdopodobnie jest klaunem).
Dymitr Iwanowicz Mendelejew, słynny chemik
Przepraszam za ten przydługi wykład, wracamy do Mendelejewa. Poza stablicowaniem pierwiastków pierwszy zauważył zjawisko kontrakcji wody z etanolem, czyli to, że jak wymieszany te dwie ciecze, to łączna objętość będzie mniejsza niż suma objętości wyjściowych. Uspokoiło to carskich urzędników, którzy inwentaryzując zapasy spirytusu rozrabianego z wodą, podejrzewali, że zmniejszenie objętości wynika z podpieprzenia przez kogoś części spirytusu. Co w sumie brzmi bardziej prawdopodobnie niż ta cała kontrakcja, ale z tego co wiem, to zjawisko potwierdzono też poza Rosją, więc ja w to wierzę.
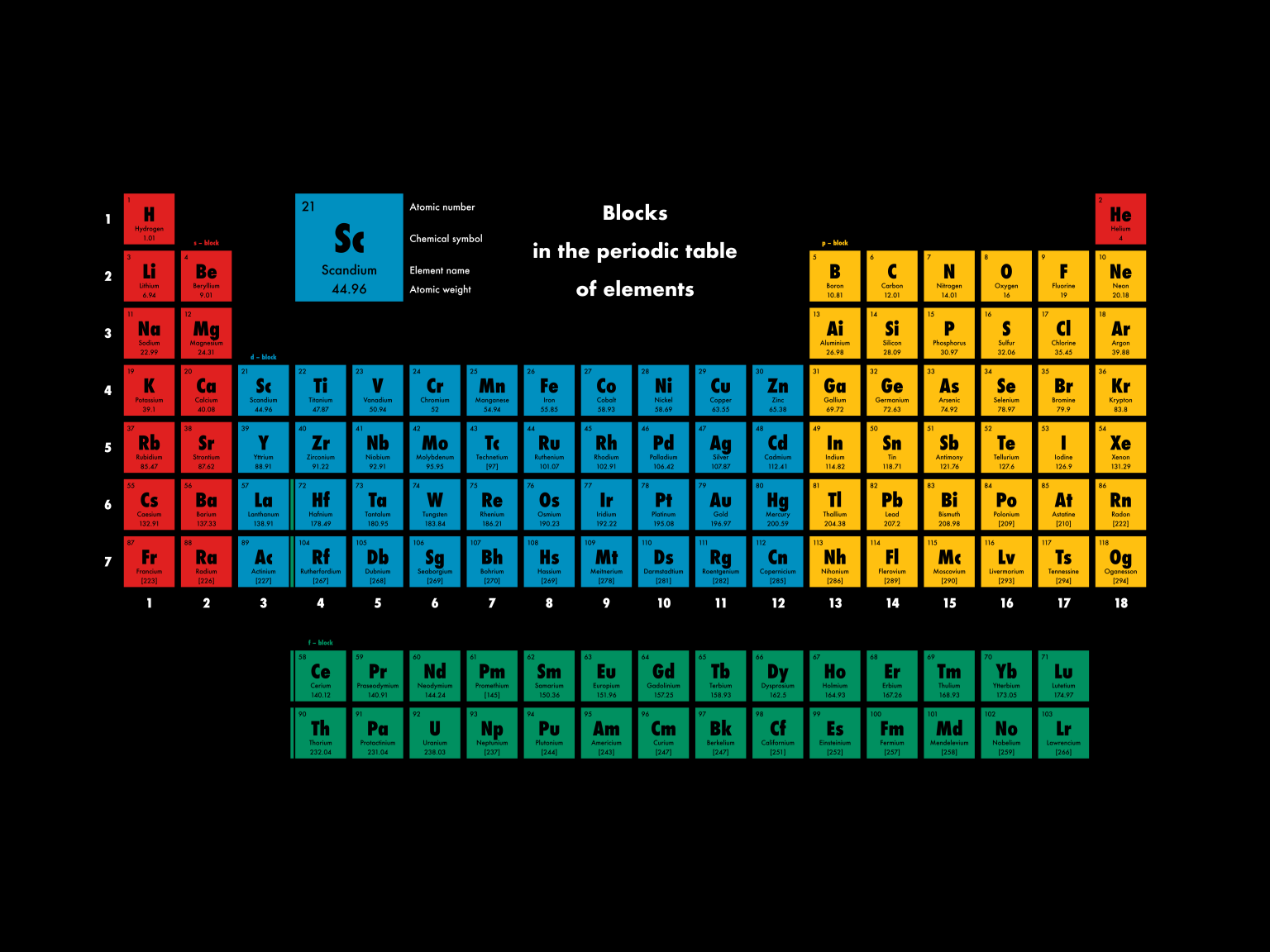
Dobra kurde, bo zaraz zapomnę, o czym miałem pisać. Mendelejew zauważył, że pierwiastki wykazują okresowo powtarzające się zestawy właściwości: temp. wrzenia, topnienia, reaktywność. Pogrupował to w tabelkę zachowując kolejność atomów od mniejszych do większych i nie dość, że się wygodniej czytało, to można było przewidzieć właściwości pierwiastków, które jeszcze nie zostały odkryte. A wtedy odkrywano dużo pierwiastków.
Z tym, że nawet pomijając nowe pierwiastki, tamta tablica bardzo różni się od obecnie używanej. Obecny kształt zawdzięczamy Nielsowi Bohrowi, którego odkrycia pozwoliły wyjaśnić, skąd te okresowe zmiany właściwości pierwiastków się biorą. Bohr odkrył, że elektrony nie są dowolnie silnie związane z jądrem, ale ta siła (energia) ma konkretne poziomy. Elektrony można więc pogrupować w powłoki. W szkole przedstawia się to jako takie orbity, ale w rzeczywistości wygląda to bardziej skomplikowanie. Niemniej najsłabiej związana z jądrem powłoka nosi nazwę walencyjnej i bierze udział w reakcjach chemicznych. Możemy więc poszeregować atomy na dwa sposoby: według liczby takich powłok i liczby elektronów na powłoce walencyjnej. Taki schemat to dzieło Bohra i jeżeli nie chcemy tych atomów ustawiać losowo i utrudniać sobie życia, to w zasadzie można przyjąć, że tablicy Mendelejewa pozbyto się już dawno. Zresztą w kontekście inwazji na Ukrainę na skancełowanie zasługuje dużo bardziej Bohr niż Mendelejew, gdyż Bohr jako pięknoduch i jebany wykształciuch w imię upośledzonego pacyfizmu dzielił się swobodnie swoimi badaniami z sowieckimi fizykami, co przyspieszyło ich program jądrowy.
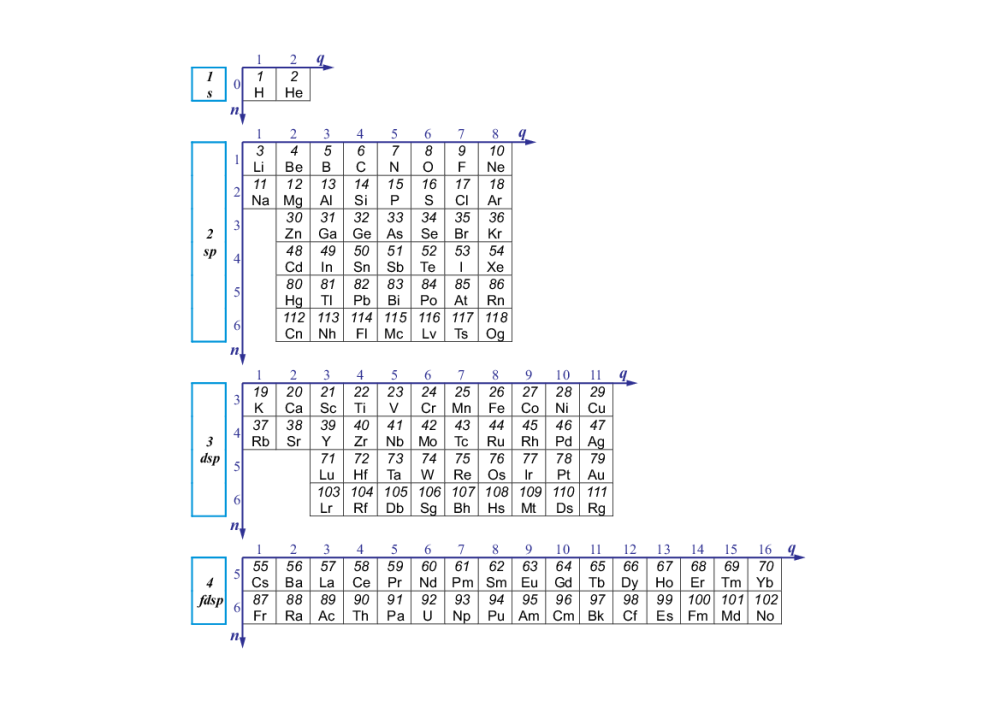
A teraz crème de la crème czyli nasz polski narodowy układ okresowy. Otóż chemicy z pewnej polskiej uczelni doszli do wstrząsającego wniosku, że skoro atom jako pojedynczy atom z liczbą elektronów równą liczbie protonów to jest zazwyczaj jakaś wydumana abstrakcja, to może warto popatrzeć na pierwiastki z innej strony. I tą nową (nową w kontekście układu okresowego) perspektywą jest rdzeń. Rdzeń kochani to jest cały atom minus ta ostatnia elektronowa powłoka walencyjna. Oczywiście taki rdzeń sam w sobie dla większości pierwiastków też nie występuje w zwykłych warunkach, ale skoro elektrony walencyjne biorą udział w tworzeniu różnych wiązań chemicznych, to zawsze taki rdzeń możemy zauważyć jako część materii, podczas gdy atom z konkretną ilością przypisanych sobie elektronów walencyjnych występuje dużo rzadziej.
Rdzeniowy układ okresowy. Cynk, kadm, rtęć i kopernik przeniesione do bloku sp, oddzielny blok s dla wodoru i helu, metale alkaliczne rozbite na 3 różne bloki
Podstawową różnicą jest inne pogrupowanie na bloki. Blok to część układu okresowego charakteryzująca się danymi właściwościami powłoki walencyjnej. Oczywiście te właściwości mają olbrzymi wpływ na właściwości chemiczne i reakcje pierwiastka. I tutaj, przynajmniej w opinii kilku polskich profesorów, podział wynikający z układu rdzeniowego dużo lepiej pokazuje właściwości pierwiastków. Także gdybyśmy serio mieli wywalać obecny układ okresowy, to mamy mocnego kandydata, RDZENIOWY UKŁAD OKRESOWY.
No i to w sumie tyle
PS Redakcja namawiała mnie swego czasu do napisania całego cyklu artykułów przybliżających naszym czytelnikom ową wspaniałą naukę, jaką jest chemia. Jeżeli po przeczytaniu tego tekstu tak jak ja uważacie, że to zły pomysł, dajcie znać w komentarzu.



Komentarze
Prześlij komentarz